El descubrimiento, publicado en la prestigiosa revista International Journal of Biological Macromolecules, puede ayudar al diseño de nuevos fármacos y terapias de rápida acción que terminen con reacciones de alergia exacerbadas, así como otras enfermedades autoinmunitarias.
Investigadores del grupo Biomembranas, del Departamento de Bioquímica y Biología Molecular A en la Facultad de Veterinaria, liderados por Senena Corbalán y Juan C. Gómez, han analizado un paso clave a nivel molecular que ocurre en la activación de la reacción alérgica, cuando un alérgeno es detectado por las células cebadas o mastocitos del organismo.
Estas células, responsables del proceso alérgico, liberan una serie de sustancias pro-inflamatorias al espacio que las rodea, provocando así ciertos efectos indeseados, estornudos, tos, hinchazón o urticaria, y que en algunos casos puede desencadenar una reacción grave (anafilaxia) que puede poner en riesgo la vida.
En este sentido, el estudio ha descubierto varios pasos de la cadena de mensajes que ocurren en el proceso alérgico. "Cuando llega un alérgeno se une al exterior de la membrana de la célula, lo cual produce una cadena de comunicaciones moleculares para indicarle a la célula que debe liberar sustancias pro-inflamatorias", explica David López, coautor de la publicación.
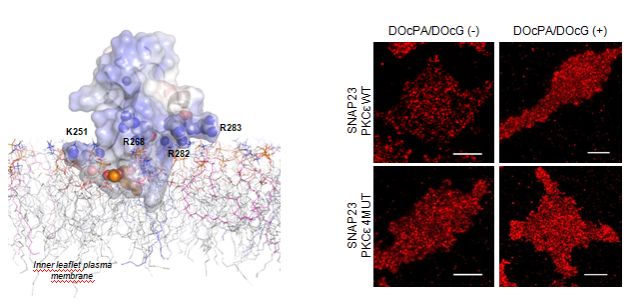
En concreto, se ha hallado la forma en que una proteína, de nombre PKCepsilon, detecta una señal que se produce como consecuencia del reconocimiento del alérgeno. Se trata del incremento de ácido fosfatidico, un lípido que se encuentra en la membrana de las células.
"Al reconocerlo, hemos descubierto que esta proteína se mueve a la membrana y allí modifica a otra proteína, llamada SNAP23, que está involucrada directamente en la liberación de sustancias inflamatorias en este tipo de células", señala López.
Cabe destacar que en esta investigación se han usado un conjunto de técnicas muy variadas, que abarcan desde la bioinformática hasta los ensayos con líneas celulares modelo inmortalizadas que sirven como sistema de estudio para comprender el proceso alérgico y minimizar el empleo de animales de laboratorio.
Implicaciones futuras
El hallazgo de los cambios moleculares que subyacen al mecanismo de los procesos alérgicos puede ayudar al diseño de nuevos fármacos antialérgicos. "Su conocimiento es clave para avanzar en nuevas terapias" concluye Emilio M. Serrano, otro de los coautores de la investigación.
David López subraya que "la señalización celular a través de lípidos es un proceso muy poco conocido, que sirve para proporcionar órdenes de funcionamiento al resto de componentes celulares", por esto, avanzar en este tipo de conocimiento permite encontrar nuevas vías de acción terapéutica.
"El diseño de fármacos que inactiven el proceso podría ser una estrategia para frenar rápidamente respuestas alérgicas desmesuradas. Los hallazgos obtenidos en este trabajo permitirán avanzar en esta dirección con mayor velocidad, puesto que ahora disponemos de una información molecular más precisa", declara Senena Corbalán.
Referencia bibliográfica:
PKCe controls the fusion of secretory vesicles in mast cells in a phosphatidic acid-dependent mode.
Serrano-López EM, López-Martínez D, Gómez-Fernández JC, Egea-Jimenez AL, Corbalán-García S. Int JBiolMacromol. 2021 Jun 17:S0141-8130(21)01219-8. doi: 10.1016/j.ijbiomac.2021.06.019. Online ahead of print.
Fotografías:
Miembros del grupo Biomembranas, del departamento de Bioquímica y Biología Molecular A.
A la izquierda, predicción structural 3D del dominio C1B de PKC epsilon y su interacción con la membrana plasmática mediado por ácido fosfatídico (representado con esferas). A la derecha, micrografías de SNAP23 (en rojo) en células RBL-2H3 en reposo y tras ser estimuladas con ácido fosfatídico y dioctanoil-glicerol.